Farmaci mancanti nelle farmacie, cosa fare se non trovi un medicinale
Vai in farmacia e non trovi il farmaco che il medico ti ha prescritto: è quello che sta succedendo sempre più spesso ai cittadini italiani ed europei, e non solo per farmaci per disturbi lievi stagionali, ma anche per malattie croniche gravi. L'Aifa segnala mensilmente oltre 3 mila farmaci introvabili: a volte le carenze sono solo momentanee, ma a volte possono durare molto a lungo o addirittura diventare croniche. Ecco da che cosa può dipendere, quali sono i doveri di farmacisti e case farmaceutiche e cosa si può fare in questi casi.

In questo articolo
- Elenco dei farmaci carenti
- Come verifico quali sono i farmaci carenti
- Cosa fare se non si trova un medicinale
- I doveri del farmacista
- Perché i farmaci sono introvabili
- Quali sono i fattori che rendono un farmaco introvabile
- Quanto può durare una carenza?
- Può un’azienda smettere di vendere un farmaco?
La costante disponibilità dei medicinali in farmacia è fondamentale per assicurare ai cittadini la continuità delle terapie. Tuttavia, il problema della mancanza dei medicinali nelle farmacie sta diventando cronico. La lista ufficiale dei farmaci carenti segnalati sul sito di Aifa (l'Agenzia italiana del farmaco) ) riporta mensilmente oltre 3mila farmaci introvabili presso le farmacie, i grossisti e le stesse aziende farmaceutiche.
A volte queste carenze sono solo momentanee e si risolvono in breve tempo. Altre volte possono durare a lungo, di solito per problemi di produzione. Purtroppo, in alcuni casi, l’indisponibilità nasce da interessi commerciali. E quando un’alternativa al medicinale mancante non esiste, la carenza del medicinale si traduce in mancato accesso alle cure.
Torna all'inizioElenco dei farmaci carenti
In questo momento sono circa 3600 i farmaci mancanti nelle farmacie segnalati da AIFA tra cessate commercializzazioni (temporanee o definitive) e difficoltà produttive, problemi di tipo regolatorio ed eccessi di richiesta che riducono la disponibilità.
Ecco alcuni farmaci carenti tra i più cercati online in questo momento.
- Augmentin, Clavulin e altri antibiotici a base di amoxicillina (da sola o con acido clavulanico). Varie formulazioni, sia di marca che generiche, sono carenti da mesi o anni per problemi produttivi ed elevata richiesta. Per molte di queste non si sa quando finirà la carenza.
- Creon e Creonipe, farmaci contenenti enzimi pancreatici, sono carenti da tempo. Purtroppo, la carenza non si risolverà prima della fine di luglio 2026. Non avendo equivalenti, ospedali e Asl possono, importare farmaco analogo dall’estero, per poi fornirlo ai pazienti.
- Ozempic, farmaco a base di semaglutide per la cura del diabete, ma sempre più utilizzato off-label per il dimagrimento è ormai carente da tempo proprio per un eccesso di richiesta (cosa che ha complicato la cura dei pazienti diabetici). La carenza è previsto finisca entro la fine del 2024.
- Victoza, farmaco per il diabete a base di liraglutide e commercializzato della stessa azienda che produce l’Ozempic, è carente dall’estate scorsa e lo sarà fino alla fine del 2024. La motivazione ufficiale è l’elevata richiesta dovuta all’uso off-label per il dimagrimento, ma anche alla riduzione della produzione da parte dell’azienda per aumentare quella di Ozempic.
- Saxenda, farmaco anch’esso a base di liraglutide, ma indicato in modo specifico per il dimagrimento, è carente per gli stessi motivi per cui sono carenti Victoza e Ozempic, cioè l’elevata richiesta. Sono tutti farmaci della stessa azienda.
- Gutron, a base di midodrina cloridrato, è un farmaco per il trattamento dell'ipotensione ortostatica. La formulazione in compresse sarà carente per problemi produttivi almeno fino al prossimo settembre. Non avendo equivalenti, l’AIFA permette l’importazione di un analogo dall’estero su richiesta di Asl o ospedale.
- Libradin, contenente barnidipina cloridrato, e usato per l'ipertensione, sarà carente per elevata richiesta fino a marzo 2025.
- Vasexten, equivalente a Librain, è purtroppo anch’esso carente fino a fine dicembre 2024. Per trattamento alternativo è necessario rivolgersi al medico.
- Spirolang, farmaco per l’iperaldosteronismo e per l'ipertensione a base di spironolattone, è carente per elevata richiesta. Le compresse da 25 mg hanno un generico (Aldactone, non carente al momento), mentre quelle da 50 mg non lo hanno. La carenza, in corso da un anno, a metà luglio dovrebbe cessare per la compressa da 25 mg. Non è chiaro invece quando finirà la carenza della compressa da 50 mg, partita a fine febbraio di quest’anno.
- Spasmex, farmaco per gli spasmi dolorosi del tratto digerente e urinario, è carenze nella sua versione in supposta fin dall’ottobre 2022. La carenza (per problemi regolatori) non ha una data di presunta fine. Non risulta invece carente la forma orale.
Come verifico quali sono i farmaci carenti
L’elenco completo e aggiornato con tutti i farmaci introvabili in farmacia è disponibile sul sito dell’AIFA nella sua pagina dedicata ai farmaci carenti.
Negli elenchi di AIFA si trovano informazioni su tutte le formulazioni mancanti nelle farmacie e se è disponibile un generico, insieme a indicazioni specifiche sul tipo di carenza. L’elenco può però essere difficile da consultare, sia per il tipo di formato, sia per la ricchezza del file, visto che contiene sempre migliaia di farmaci introvabili. C’è però una soluzione più semplice che Aifa ha di recente messo a disposizione dei cittadini all’interno del suo nuovo portale sui medicinali.
Se nella banca dati di Aifa si inserisce il nome del farmaco o del principio attivo a cui si è interessati - per esempio, l’antibiotico Augmentin – la banca dati offrirà tutte le specialità autorizzate che rispondano a quel nome, indicando tra le varie informazioni se ci sono possibili carenze. Ecco un esempio: le carenze sono indicate in un bollo rosso a margine della scheda di ogni farmaco.
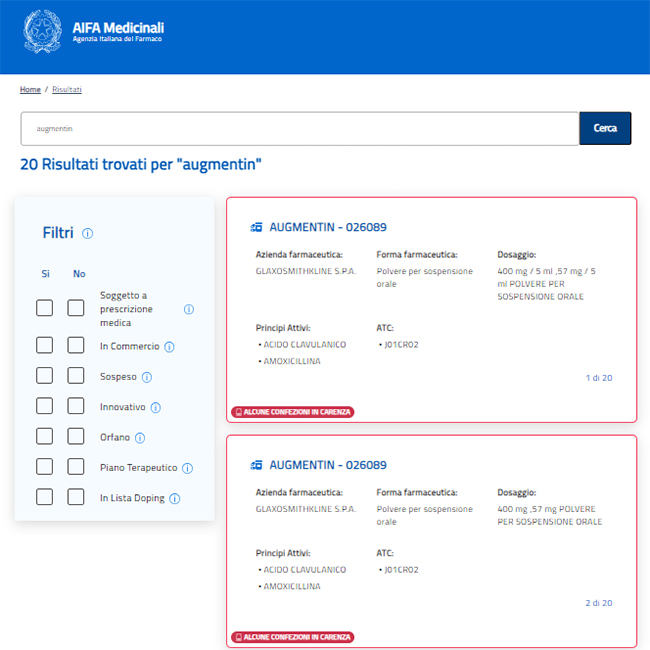
Cosa fare se non si trova un medicinale
Ecco cosa si può fare:
Chiedere al farmacista: Il farmacista è tenuto ad aiutarti a trovare una soluzione. Se il farmaco non è disponibile, può verificare la disponibilità presso altre farmacie o suggerire alternative terapeutiche equivalenti. Quando non trova il farmaco nella sua rete di distribuzione, deve ordinarlo direttamente all’azienda farmaceutica.
Consultare il tuo medico: se il farmacista non è riuscito ad aiutarti perché il farmaco risulta carente, parlane con il tuo medico curante. Sara lui a valutare se prescrivere un farmaco equivalente a quello che assumi di solito o se sostituirlo con un altro medicinale con le stesse indicazioni terapeutiche. In alcuni casi, quando un farmaco risulta ufficialmente carente, le Asl e gli ospedali possono richiedere ad Aifa il permesso di importare un farmaco equivalente commercializzato all’estero, per poi distribuirlo ai pazienti. Per importare un farmaco dall’estero i medici devono seguire le indicazioni fornite da AIFA.
Segnalaci la carenza: se ripetutamente non trovi un medicinale, segnalaci la carenza. Grazie alle vostre segnalazioni, negli anni abbiamo individuato carenze che nascondevano distorsioni o veri e propri abusi, e che poi abbiamo denunciato.
Torna all'inizioI doveri del farmacista
Le farmacie, i grossisti e le aziende farmaceutiche hanno il dovere di fornire i farmaci prescritti ed assicurare una fornitura stabile e continua dei medicinali, secondo quanto stabilito dalla legge all art. 105 e 109 del D.Lgs n. 219/2006.
Ecco quali sono:
- Se il farmacista non ha il medicinale che avete richiesto, deve richiederlo al distributore, che è tenuto a consegnarlo entro le 12 ore lavorative successive alla richiesta.
- Se il farmaco risulta carente anche per i grossisti a cui è stato richiesto, il farmacista è tenuto a richiedere il medicinale direttamente all’azienda produttrice, la quale è obbligata a fornirlo entro 48 ore.
Se l’azienda non è in grado di fornire il farmaco, il farmacista deve segnalare la carenza alle autorità preposte. Se invece il farmaco risulta già ufficialmente carente, il farmacista è tenuto a supportare il cittadino dandogli le eventuali indicazioni fornite nell’elenco dei farmaci carenti (ad esempio, della necessità di recarsi dal medico per valutare terapie alternative o altre comunicazioni più specifiche)
Questi obblighi valgono anche per integratori, dispositivi medici, cosmetici?
No, non valgono. Nonostante siano venduti anche in farmacia, questi prodotti non farmaceutici non godono di queste garanzie.
Perché i farmaci sono introvabili
I motivi per cui i farmaci possono essere carenti per periodi più o meno lunghi sono vari.
Dipendono infatti dalla complessità della catena di produzione e distribuzione dei farmaci, fatta di tanti anelli interdipendenti e dislocati in più parti del mondo.
Ci sono aziende farmaceutiche che producono il farmaco completamente da sé, avendo così un maggiore controllo sull’intera filiera del farmaco; molte però si appoggiano ad altre aziende sia per la fornitura delle materie prime (compresi i principi attivi e gli eccipienti) sia per la produzione ed il confezionamento dei farmaci.
Spesso le aziende che forniscono le sostanze chimiche necessarie a fare i farmaci si trovano in Cina e India. Le aziende farmaceutiche a livello globale dipendono fortemente da queste, con l’effetto di accentrare in pochi paesi e in poche aziende dei passaggi chiave della produzione dei medicinali. Quando il medicinale è pronto, viene venduto alle farmacie direttamente dalle aziende farmaceutiche o da intermediari - i grossisti - che a loro volta possono rivenderli ad altri grossisti (anche all’estero).
Come è facile intuire, basta che uno dei nodi della rete “salti” o abbia un problema perché la disponibilità del medicinale vada sia subito messa a rischio.
Torna all'inizioQuali sono i fattori che rendono un farmaco introvabile
Un medicinale può essere carente a causa di diversi fattori:
- elevata richiesta di un medicinale. Ad esempio, durante l’inverno i malanni stagionali possono causare carenza di paracetamolo e ibuprofene
- problemi legati alla produzione. Ad esempio, l’azienda non riesce a reperire il principio attivo o riscontra altri problemi a livello produttivo
- problemi logistici che hanno un impatto sulla distribuzione del farmaco
- provvedimenti regolatori. Ad esempio, quando l’autorità regolatoria decide di sospendere la commercializzazione di un farmaco per motivi di sicurezza
- motivi commerciali. L’azienda può smettere di produrre un farmaco se non lo ritiene più un’attività remunerativa
- distorsioni del mercato legate al fenomeno della distribuzione parallela. Si tratta di una esportazione (legale) da parte di grossisti in Paesi esteri dove è più redditizio vendere i farmaci, che lascia però scoperto il fabbisogno del territorio.
Quanto può durare una carenza?
Dipende dal tipo di problema che l’ha scatenata. In alcuni casi il farmaco mancante torna disponibile in poche settimane, in altri casi è necessario aspettare mesi o anni prima di poterlo trovare nuovamente in farmacia. Purtroppo, ci sono anche casi in cui il problema della carenza non si risolve perché il farmaco è stato tolto dal commercio.
I motivi che possono ad una carenza, come abbiamo visto, sono vari e vanno da comprensibili difficoltà produttive alla meno comprensibile - per i pazienti - scarsa convenienza economica nel produrre e vendere un medicinale.
Torna all'inizioPuò un’azienda smettere di vendere un farmaco?
Si, un’azienda ha diritto ad interrompere la commercializzazione di un farmaco. Può farlo anche quando manca un farmaco equivalente in commercio o quando le ragioni di tale interruzione siano di natura prettamente commerciali. Se intende farlo, deve solo comunicare la sua decisione all’AIFA almeno due mesi prima dell’interruzione.
A stabilirlo è l’attuale normativa che regola l’immissione in commercio dei farmaci (art. 34 e 38 del D.Lgs. n. 219/2006). L’AIFA e il Ministero della Salute non hanno alcuna voce in capitolo e non possono interferire con la libera impresa, come ha affermato anche il TAR Lazio, nella sentenza n. 8623/2012.
Un’azienda farmaceutica può anche decidere di cessare la commercializzazione di un farmaco in un paese europeo ma continuare a produrlo e commercializzarlo in un altro.
Torna all'inizio
