Farmaci più sicuri grazie all’etichetta anticontraffazione
Dal febbraio 2025 sono in vigore nuove regole sul fronte degli imballaggi dei farmaci. Sulle confezioni devono essere apposti un codice identificativo europeo e un dispositivo antimanomissione per garantire l'assoluta autenticità del prodotto. Il bollino della Zecca resta, ma soltanto per i farmaci da banco e pochi altri. Le aziende avranno due anni per adeguarsi ai nuovi requisiti.
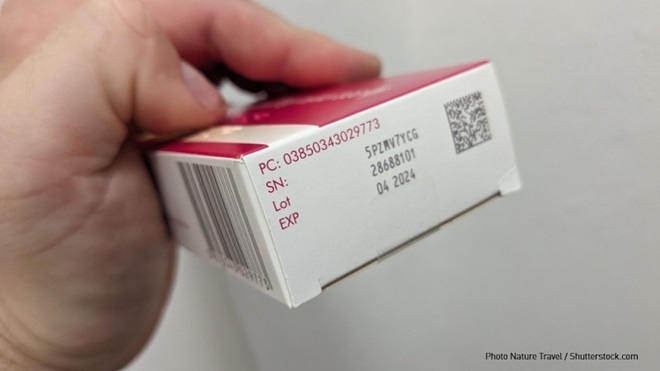
In Italia l’autenticità dei farmaci venduti nelle farmacie è tradizionalmente garantita da un bollino prodotto dall'Istituto Poligrafico e Zecca dello Stato (IPZS) e apposto su tutte le confezioni. Un sistema che ha permesso di garantire il primato del Paese con il minor numero di farmaci contraffatti al mondo: solo lo 0,1% contro una media globale del 6-7% (dati AIFA). Dal mese di febbraio, con il Decreto legislativo 10 del 6/2/2025 che dà attuazione al Regolamento UE 2016/161, questo metodo nazionale è stato integrato con quello europeo, che prevede alcuni elementi in più a tutela della tracciabilità della filiera.
Ecco come cambiano le confezioni dei farmaci
Sulle confezioni dei farmaci deve essere stampato direttamente dal produttore un identificativo univoco sotto forma di codice "datamatrix" a lettura ottica (accompagnato, se la confezione non è troppo piccola, da alcune parti in formato leggibile dall’uomo). Inoltre tutte le scatole devono avere anche un dispositivo antimanomissione.
Per tutti i farmaci non soggetti all'identificativo univoco, quindi fino a oggi quelli da banco ma le cose potrebbero cambiare in futuro, continuerà a essere applicato il bollino farmaceutico della Zecca che consente di assicurare l'autenticità dei farmaci, anticontraffazione, la tracciabilità e il monitoraggio della spesa sanitaria associata.
Chi verifica l’autenticità dei farmaci
Sia i fabbricanti che i farmacisti devono verificare l’autenticità dell’identificativo univoco dei medicinali. Anche i grossisti sono tenuti a controllare l’autenticità dell’identificativo univoco prima di distribuire i medicinali.
In caso di “sospetta manomissione dell’imballaggio o di falsificazione di un medicinale, i fabbricanti, i grossisti e i soggetti autorizzati o legittimati a fornire medicinali al pubblico informano immediatamente le autorità competenti”.
Sanzioni severe
Le sanzioni per chi trasgredisce sono particolarmente severe: i fabbricanti, i grossisti e i titolari di un’autorizzazione all'immissione in commercio rischiano multe fino a 140 mila euro in caso non rispettino le regole sull’apposizione dell’identificativo univoco e sulla commercializzazione di medicinali non conformi , mentre sanzioni significative sono previste anche per chi non verifica correttamente l'autenticità dell'identificativo univoco o non segue le disposizioni per la sua disattivazione o riattivazione.
Tempi di adeguamento graduali
Il decreto prevede un piano di adeguamento graduale: dal 9 febbraio 2025 all’8 febbraio 2027 è previsto un periodo di stabilizzazione per le operazioni di apposizione e attivazione, verifica, disattivazione e riattivazione dell’identificativo univoco, secondo le istruzioni operative definite dal ministero della Salute.
In luglio sono state pubblicate le istruzioni applicative per le nuove procedure di rilascio dell’autorizzazione. Da quel momento, ogni nuova richiesta di autorizzazione all’immissione in commercio deve includere le informazioni sull’identificativo e sul sistema di sicurezza. A inizio ottobre l’Agenzia Italiana del Farmaco ha reso pubblico un documento di chiarimento: tutti i farmaci con ricetta, salvo poche eccezioni come i gas medicinali, devono avere sull’imballaggio il codice identificativo univoco datamatrix e un sistema antimanomissione su carta valori. Sono comunque previsti due anni di regime transitorio in cui potranno convivere le vecchie confezioni con quelle nuove.

